尺寸排除色譜法
此條目翻譯品質不佳。 (2020年4月28日) |
 運行尺寸排除色譜的設備。緩衝物由一個計算機控制的裝置通過柱子(右)泵出 | |
| 英文縮寫 | SEC |
|---|---|
| 分類 | 色譜法 |
| 分析對象 | 高分子 合成高分子 生物分子 |
| 生產廠家 | GE, Bio-Rad, Knauer, emp Biotech |
| 其它技術 | |
| 其它技術 | 高效液相色譜法 水正相色譜法 離子交換色譜法 膠束液相色譜法 |
尺寸排除色譜法(英語:Size-exclusion chromatography,縮寫:SEC),也稱為分子篩色譜法, [1]是一種將溶液中的分子按其大小(在某些情況下為分子量)分開的色譜法。 [2]這種方法通常被用於分離大分子或高分子複合物(例如蛋白質和工業聚合物)。當使用水溶液將樣品運輸通過色譜柱時,該技術通常稱作凝膠過濾色譜法,而不是叫做凝膠滲透色譜法(用有機溶劑作流動相時使用的技術才叫凝膠滲透色譜法)。色譜柱中裝有細小的多孔珠,它們的成分是葡聚糖聚合物(Sephadex)、瓊脂糖(Sepharose)或聚丙烯醯胺(Sephacryl或BioGel P)。其孔徑用於估計大分子的尺寸。SEC因為能夠為聚合物提供良好的摩爾質量分布(Mw)結果,被廣泛使用作聚合物表徵方法。
應用
[編輯]凝膠過濾色譜法主要用於分離蛋白質和其他水溶性聚合物。凝膠滲透色譜法則用於分析有機可溶性聚合物的分子量分布。不同於上述兩種技術,凝膠電泳根據分子的電荷使用電場將分子「拉」或「推」過凝膠。溶質保留在孔中的時間長短取決於孔的大小。較大的溶質將獲得較小的體積,反之亦然。因此,與較大的溶質相比,較小的溶質將在孔內保留更久。[3]
尺寸排阻色譜法的另一種用途是檢查水中天然有機物的穩定性和特徵。[4]Margit B. Muller,Daniel Schmitt和Fritz H.Frimmel用這種方法測試了世界各地的水源,以確定一段時間內天然有機物的穩定性。尺寸排阻色譜法被廣泛用於研究天然有機物質,但仍存在局限性。缺點之一包括沒有標準的分子量標記(沒有可以比較的相對標準)。如果需要精確的分子量,則應使用其他方法。
優點
[編輯]該方法的優點包括用最少的洗脫液[a]即可將大分子與小分子很好地分離,[5]在不干擾過濾過程時,可以使用各種溶液,同時保持分離的顆粒物的生物活性。該技術通常與其他技術結合使用,從而通過其他特性(例如酸鹼度、電荷和對某些化合物的親和力)進一步分離分子。尺寸排阻色譜分離時間短,分離譜帶窄,靈敏度高。由於溶質不與固定相相互作用,因此也沒有樣品損失。
該實驗方法的另一個優點是在某些情況下可以確定化合物的近似分子量。化合物(洗脫液)的形狀和大小決定了化合物如何與凝膠(固定相)相互作用。為了確定近似分子量,獲得具有相應分子量的化合物的洗脫體積,繪製Kav - log(Mw)圖,其中 ,Mw是分子量。 該圖用作校準曲線,用於估測所需化合物的分子量。Ve成分代表中間分子(例如部分接近色譜柱珠子的分子)洗脫的體積。而Vt是珠粒之間的總體積與珠粒內的體積之和。 Vo組分表示大分子開始洗脫時的體積[b]。[6] [7]這種實驗方法的一個缺點是,由於色譜圖的時間尺度很短,因此只能容納有限數量的譜帶。通常分子質量必須相差10%才能具有良好的解析度。 [5]
發現
[編輯]1955年,倫敦夏洛特皇后醫院的格蘭特·亨利·拉特(Grant Henry Lathe)和科林·魯斯芬(Colin R Ruthven)發明該技術。 [8][9] 他們後來因這項發明獲得了約翰·斯科特獎。[10]Lathe和Ruthven使用澱粉凝膠作為基質,而隨後Jerker Porath和Per Flodin引入了葡聚糖凝膠;[11]其他具有大小分級特性的凝膠包括瓊脂糖和聚丙烯醯胺。 [12]
也有人嘗試過分餾合成的高聚物。然而,直到1964年,陶氏化學公司的JC Moore發表了他基於孔徑受控的交聯聚苯乙烯製備凝膠滲透色譜(GPC)色譜柱工作時, [13]這一領域的研究活動才開始迅速增加。人們幾乎立即認識到,通過適當的校準,GPC能夠提供合成聚合物的摩爾質量和摩爾質量分布信息。由於後者很難通過其他方法獲得,因此GPC迅速被廣泛使用。 [14]
理論與方法
[編輯]
SEC主要用於分析大分子,例如蛋白質或聚合物。 SEC的工作原理是將較小的分子捕獲在吸附劑的孔中(「固定相」)。 該過程通常在層析柱內進行,層析柱實際上是一段中空管,其中緊密填充有微米級聚合物珠,聚合物珠包含不同大小的孔隙。 這些孔隙可能是表面上的凹陷或穿過珠子的通道。當溶液向下流過色譜柱時,一些顆粒進入孔隙中。較大的顆粒無法進入所有的孔隙,而只能從較小的孔隙的外側繞過。因此,分子越大,洗脫速度越快,分子越小,在層析柱內的保留時間越長。
SEC的一項要求是分析物不與固定相表面相互作用,理想情況下,分析物之間的洗脫時間差異完全基於分析物可以進入的溶質空間,而與分析物與固定相的化學或靜電相互作用無關。 因此,能夠穿透固定相孔隙系統的每個區域的小分子可以進入的空間為整個孔隙空間和顆粒間空間之和。這種小分子洗脫較晚(在分子滲透完所有的孔和顆粒間體積後(大約是色譜柱體積[c]的80%))。 另一方面,不能穿透任何較小孔的極大分子只能進入顆粒間空間(約占色譜柱體積的35%),並在此空間的流動相通過色譜柱時更早地洗脫。 SEC的基本原理是,不同大小的顆粒以不同的速率通過固定相洗脫(過濾)。這導致溶液顆粒按尺寸分離。如果所有粒子同時或接近同時裝載,則相同大小的粒子應一起洗脫。
但是,由於有多種測量大分子大小的參數(例如迴轉半徑和流體動力學半徑),SEC理論中的一個基本問題是選擇合適的分子大小參數來分離不同種類的分子。 通過實驗,Benoit及其同事發現了洗脫體積與基於動力學的分子大小(流體動力學體積)之間的相關性極好,結論適用於幾種不同的鏈結構和化學組成。[15]以流體動力量來校準SEC是可接受的通用做法。
但是,在解釋SEC數據時,仍未完全理解為什麼使用基於動力學特性的大小的流體動力學體積。[16] 因為SEC通常在低流速條件下運行,在該條件下流體動力因素對分離的影響很小。實際上,理論和計算機模擬均假定其為熱力學分離原理:分離過程由溶質大分子在位於間隙空間的稀體積溶液相和柱填料孔內的受限溶液相之間的平衡分布(分配)決定。基於該理論,已經表明與聚合物在孔中分配有關的尺寸參數是平均跨度尺寸(平均最大投影到一條線上)。 [17] 儘管此問題尚未完全解決,但平均跨距尺寸和流體動力體積可能緊密相關。

每個尺寸排除色譜柱都可以分離一系列的分子量。排除極限定義了色譜柱「工作」範圍分子量最大值,這時分子太大而不能被困在固定相。色譜柱「工作」範圍的下限是滲透極限。滲透極限定義為足以穿透固定相的所有孔的分子的分子量。 低於該分子量的所有分子都非常小,洗脫為一條帶。 [5]
以下是尺寸排阻色譜法中通常用於多孔凝膠珠的材料[18]
| 序號 | 材料
和商品名稱 |
分離範圍
(Da的分子質量) |
|---|---|---|
| 1個 | 葡聚糖凝膠G-10 | 0至700 |
| 2 | 葡聚糖凝膠G-25 | 1000至5000 |
| 3 | 葡聚糖凝膠G-50 | 1500至30000 |
| 4 | 葡聚糖凝膠G-75 | 3000至70000 |
| 5 | 葡聚糖凝膠G-100 | 4000至150000 |
| 6 | 葡聚糖凝膠G-150 | 5000至300000 |
| 7 | 葡聚糖凝膠G-200 | 5000至800000 |
| 8 | 生物凝膠P-2 | 100至1800 |
| 9 | 生物凝膠P-6 | 1000至6000 |
| 10 | 生物凝膠P-60 | 3000至60000 |
| 11 | 生物凝膠P-150 | 15000至150000 |
| 12 | 生物凝膠P-300 | 16000至400000 |
| 13 | 瓊脂糖凝膠2B | 2 x 10 6至25 x 10 6 |
| 14 | 瓊脂糖凝膠4B | 3 x 10 5至3 x 10 6 |
| 15 | 瓊脂糖凝膠6B | 10 4至20 x 10 6 |
影響過濾的因素
[編輯]
在現實中,溶液中的顆粒尺寸不固定,這就導致了顆粒可能會受到它原本會穿過的孔隙的阻礙。同樣,固定相顆粒的定義也不夠理想。顆粒和孔的大小可能會有所不同。因此,洗脫曲線類似於高斯分布曲線。固定相還可能以意料外的方式與顆粒相互作用,並影響保留時間,儘管色譜柱製造商非常注意使用惰性的固定相併使此問題最小化。
像其他色譜法一樣,增加色譜柱長度可提高分離度,而增加色譜柱直徑可提高色譜柱容量。適當的色譜柱填充對於最大分離度很重要:過度填充的色譜柱可能會使珠子中的孔隙塌陷,導致分離度下降。裝填不足的色譜柱可能減少較小物質可及的固定相的相對表面積,從而減少固定相停留在孔隙中的時間。與親和色譜技術不同,色譜柱頂部的溶劑頭會大大降低分離度,因為樣品在上樣之前會擴散,從而擴大了下游洗脫範圍。
分析
[編輯]在簡單的手動色譜柱中,洗脫液以恆定體積(稱為分數)收集。 顆粒的尺寸越相似,它們處於同一組分且不會被單獨檢出的可能性就越大。 更高級的色譜柱通過不斷監控洗脫液來解決此問題。
經常通過光譜技術檢查收集的級分,以確定洗脫的顆粒的濃度。常用的光譜檢測技術是折射率(RI)和紫外光譜(UV)。當洗脫物質的光譜相似時(例如在生物純化過程中),可能需要其他技術來鑑定每個餾分的含量。 還可以使用RI, LALLS , 多角度雷射散射MALS,UV和/或粘度測量來連續分析洗脫液流量。

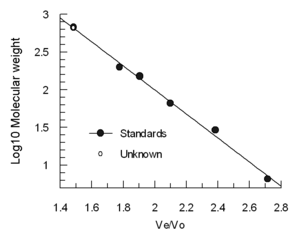
洗脫體積(Ve)與分子流體動力學體積的對數大致呈線性關係。 通常使用4-5個標準樣品(例如,已知分子量的摺疊蛋白質)和包含非常大的分子(例如甲狀腺球蛋白)的樣品來校準色譜柱,以測定空隙體積 。 (不建議使用藍色右旋糖酐進行Vo測定,因為它是異質的,可能給出多種結果)將標準溶液的洗脫體積除以甲狀腺球蛋白的洗脫體積(Ve / Vo),並相對於標準分子量的對數作圖。
應用領域
[編輯]生化應用
[編輯]通常,SEC被認為是低解析度色譜,因為它不能很好地識別相似的物種,因此通常保留用於純化的最終步驟。該技術可以確定具有較慢交換時間的純化蛋白的四級結構,因為它可以在天然溶液條件下進行,並保留了大分子相互作用。 SEC還可以測定蛋白質的三級結構 ,因為它可以測量流體動力學體積(而非分子量),從而可以區分同一蛋白質的摺疊形式和非摺疊形式。例如,對於摺疊形式和未摺疊形式,典型蛋白質結構域的表觀流體力學半徑可能分別為14Å和36Å。 SEC可以使這兩種形式分離,因為摺疊形式由於其較小的尺寸而在較後才洗脫。
聚合物合成
[編輯]SEC可以用來衡量合成聚合物的大小和多分散性(發現聚合物分子大小分布的能力)。如果事先通過了已知大小的標準品,則可以創建校準曲線以確定在所選用於分析的溶劑(通常為THF)中感興趣的聚合物分子的大小。以另一種方式,可以在SEC上在線使用諸如光散射和/或粘度測定等技術來得到絕對分子量(不依賴於已知分子量標準的校準)。 由於具有分子量的兩種聚合物的尺寸也有差異,絕對測定方法通常是更可取的。一個典型的SEC系統可以快速(約半小時)為聚合物化學家提供有關樣品尺寸和多分散性的信息。 製備型SEC可用於分析規模的聚合物分餾 。
缺點
[編輯]在SEC中,質量的測量遠不如聚合物分子的流體力學體積,即特定的聚合物分子在溶液中占據了多少空間。 然而,由於分子量與聚苯乙烯的流體力學體積之間的確定關係,可以從SEC數據計算出近似分子量。 所以以聚苯乙烯為質量測量標準。 但是,對於不同聚合物,流體動力學體積與分子量之間的關係並不相同,因此只能獲得近似的測量值。 [19] 另一個缺點是固定相和分析物可能相互作用。 任何相互作用都會導致洗脫時間較晚,以致推出的分析物尺寸較小。
執行此方法時,洗脫分子的譜帶可能會變寬。原因可能是流動相分子流過固定相分子引起的湍流。另外,玻璃壁分子與洗脫液分子之間的分子熱擴散和摩擦也使譜帶變寬。這些帶除了變寬之外也彼此重疊。 結果導致洗脫液通常會被稀釋。可以採取一些預防措施來防止譜帶變寬。例如可以在柱子頂部的狹窄、高度集中的條帶中施加樣品。 洗脫液越濃,該過程將越有效。然而,洗脫液並非總是能夠濃縮的,這可以被認為是另一個缺點。 [7]
絕對尺寸排阻色譜
[編輯]絕對尺寸排阻色譜(ASEC)是一種將動態光散射 (DLS)儀器與尺寸排阻色譜系統耦合的技術,用於測量從色譜系統洗脫的蛋白質和大分子的絕對尺寸。
在這種情況下,「絕對」的定義是不需要校準即可獲得流體動力學尺寸(通常稱為流體動力學直徑,符號DH,單位nm)。 當大分子從尺寸排阻色譜柱組洗脫到DLS儀器的流通池中時,測量分子或顆粒的流體動力學尺寸(不是其分子量)。對於蛋白質,可以使用Mark-Houwink類型的計算方法來根據流體動力學大小估算分子量。
DLS與SEC結合的主要優點是能夠獲得增強的DLS解析度。 [20] 批處理DLS快速簡便,可以直接測量平均大小,但DLS的基線解析度為直徑3到1。 使用SEC,可以分離蛋白質和蛋白質寡聚物,從而實現寡聚體拆分。 也可以使用ASEC進行聚集體研究。 儘管可能無法計算出聚集體濃度,但是可以測量聚集體的大小,僅受SEC柱洗脫的最大大小限制。
ASEC的缺點包括流速、濃度和精度。由於相關函數需要3–7秒鐘的時間才能正確構建,因此只能在整個峰中收集到有限數量的數據點。
注釋
[編輯]參見
[編輯]參考文獻
[編輯]- ^ Garrett, Reginald H.; Grisham, Charles M. Biochemistry (vanc) 5th. Belmont, CA: Brooks/Cole, Cengage Learning. 2013: 108. ISBN 9781133106296. OCLC 1066452448.
- ^ Paul-Dauphin, S; Karaca, F; Morgan, TJ; Millan-Agorio, M; Herod, AA; Kandiyoti, R. Probing Size Exclusion Mechanisms of Complex Hydrocarbon Mixtures: The Effect of Altering Eluent Compositions. Energy & Fuels. 6. 6 Oct 2007, 21 (6): 3484–3489. doi:10.1021/ef700410e.
- ^ Size exclusion chromatography does not require pores. Proceedings of the National Academy of Sciences of the United States of America. June 2000, 97 (13): 7064–7. Bibcode:2000PNAS...97.7064B. JSTOR 122767. PMC 16499
 . PMID 10852951. doi:10.1073/pnas.120129097.
. PMID 10852951. doi:10.1073/pnas.120129097.
- ^ Fractionation of Natural Organic Matter by Size Exclusion Chromatography−Properties and Stability of Fractions. Environ Sci Technol. 1 Dec 2000, 34 (23): 4867–4872. Bibcode:2000EnST...34.4867M. doi:10.1021/es000076v.
- ^ 5.0 5.1 5.2 Skoog, Douglas A.; Holler, F. James; Crouch, Stanley R. http://zeus.qui.ufmg.br/~valmir/livros/analitica/Principles%20of%20Instrumental%20Analysis%20(6ed)%20-%20Skoog,%20Holler%20&%20Crouch.pdf
|chapterurl=缺少標題 (幫助) (PDF). Ch. 28. Liquid Chromatography (vanc) 6th. Belmont, CA: Thomson Brooks/Cole. 2006: 816 [2020-10-08]. ISBN 9780495012016. LCCN 2006926952. OCLC 77224390. (原始內容存檔 (PDF)於2019-01-03). 引用錯誤:帶有name屬性「:0」的<ref>標籤用不同內容定義了多次 - ^ Rouessac, Annick; Rouessac, Francis. Chemical analysis: modern instrumental methods and techniques (vanc) Engl. Chichester: Wiley. 2000: 101–103. ISBN 978-0471972617. OCLC 635171657.
- ^ 7.0 7.1 Ballou, David P.; Benore, Marilee; Ninfa, Alexander J. Fundamental laboratory approaches for biochemistry and biotechnology (vanc) 2nd. Hoboken, N.J.: Wiley. 2008: 127–129. ISBN 9780470087664.
- ^ The separation of substances on the basis of their molecular weights, using columns of starch and water. The Biochemical Journal. August 1955, 60 (4): xxxiv. PMC 1216175
 . PMID 13249976.
. PMID 13249976.
- ^ The separation of substances and estimation of their relative molecular sizes by the use of columns of starch in water. The Biochemical Journal. April 1956, 62 (4): 665–74. PMC 1215979
 . PMID 13315231. doi:10.1042/bj0620665.
. PMID 13315231. doi:10.1042/bj0620665.
- ^ The John Scott Award Recipients From 1822 - present. garfield.library.upenn.edu. [3 Jan 2019]. (原始內容存檔於2020-03-16).
- ^ Gel filtration: a method for desalting and group separation. Nature. June 1959, 183 (4676): 1657–9. PMID 13666849. doi:10.1038/1831657a0.
- ^ Adventures in the matrix. Nature Methods. 2006, 3 (5): 410. ISSN 1548-7105. doi:10.1038/nmeth0506-410.
- ^ Gel permeation chromatography. I. A new method for molecular weight distribution of high polymers. J Polym Sci A. 1964, 2 (2): 835–843. ISSN 1542-6246. doi:10.1002/pol.1964.100020220.
- ^ Striegel, Andre; Yau, Wallace W.; Kirkland, Joseph J.; Bly, Donald D. Modern Size-Exclusion Liquid Chromatography: Practice of Gel Permeation and Gel Filtration Chromatography (vanc) 2nd. Hoboken, N.J.: Wiley. 2009. ISBN 9780470442876. OCLC 587401945.
- ^ A universal calibration for gel permeation chromatography. J Polym Sci B. 1967, 5 (9): 753–759. ISSN 1542-6254. doi:10.1002/pol.1967.110050903.
- ^ A Study of the Separation Principle in Size Exclusion Chromatography. Macromolecules. 2004, 37 (11): 4304–4312. ISSN 0024-9297. doi:10.1021/ma030586k.
- ^ A Theoretical Study of the Separation Principle in Size Exclusion Chromatography. Macromolecules. 2010, 43 (3): 1651–1659. ISSN 0024-9297. doi:10.1021/ma902377g.
- ^ Kumar, Pranav. Fundamentals and techniques of Biophysics and Molecular biology. New Delhi: Pathfinder Publication. 2018: 05. ISBN 978-93-80473-15-4.
- ^ Size Exclusion Chromatograhy. pslc.ws. Polymer Science Learning Center (PSLC). 2005 [3 Jan 2019]. (原始內容存檔於2018-05-12).
- ^ Herold, Keith E.; Rasooly, Avraham. Lab on a chip technology: Biomolecular separation and analysis (vanc) 2. Norfolk, UK: Horizon Scientific Press. 2009: 170. ISBN 9781904455462. OCLC 430080586.
外部連結
[編輯]| 關於Gel permeation chromatography 的圖書館資源 |

