腈

−C≡N 基團稱作氰基,在 −CN 基團中碳原子和氮原子通過三鍵鍵合在一起。無機化學中帶有此官能團者為氰,而不稱「腈」。[2]
許多含氰基的化合物都具有高毒性。
歷史
[編輯]氫氰酸首次由卡爾·威廉·舍勒於1782年成功合成。[3] 1811年,由約瑟夫·路易·蓋-呂薩克合成出純淨的氫氰酸,這是一種劇毒且具揮發性的酸。氰基苯甲酸首先由弗里德里希·維勒和尤斯圖斯·馮·李比希合成,但是由於當時的合成收率很低結果沒有得到其理化數據,也沒有得到它的假定結構。泰奧菲勒-朱爾·皮樂茨於1834年合成出了丙腈並且假設此化合物是一個含有氫氰酸的醚類化合物。[4] Hermann Fehling於1844年通過加熱苯甲酸銨合成了苯腈,這是首個獲得足夠量以用於化學研究合成方法。 他通過加熱甲酸銨的結果比對得到的物質以確定該結構。他為該新發現的化合物命名為腈,而這也成為了官能團的名稱。[5]
合成
[編輯]工業中, 主要合成腈的方法是氨氧化和氫氰化。這兩種路線都符合綠色化學,因為在反應中不會產生等當量的鹽。在氨氧化反應中,烴分子在氨的存在下被部分氧化,這個轉化被用於大量的合成丙烯腈。[6]
- CH3CH=CH2 + 3/2 O2 + NH3 → NCCH=CH2 + 3 H2O
- CH2=CH-CH=CH2 + 2 HCN → NC(CH2)4CN
在許多特殊的應用中,腈還可以通過下列方法進行合成:
- 脂肪族親核取代反應:在Kolbe腈合成中,鹵代烴和金屬氰化物(氰鹽)反應。芳香腈通過Rosenmund-von Braun合成法製備。
- 通過一級酰胺的脫水製備腈。許多試劑都可以用來作為脫水試劑:二氯磷酸甲酯和DBU的組合試劑就是其中的一種。
- 從芳香羧酸合成腈(Letts腈合成)。
- 在Sandmeyer反應中,芳香腈從偶氮化合物合成。
- 一個引入氰基的商業化試劑:氰基二乙基鋁(Et2AlCN)可以通過三乙基鋁和HCN合成。[9].這個試劑被用於對酮類的親核加成反應。[10] 例如其應用:Kuwajima紫杉醇全合成。
- 氰離子很容易讓二溴化合物發生偶聯反應。α,α'-二溴己二酸與氰化鈉在乙醇當中反應得到氰基環丁烷:[11]
- 在Franchimont反應(A. P. N. Franchimont,1872年)中,一個α-溴代羧酸在氰基水解和脫羧反應後發生了二聚反應。[12]
- 芳香腈可以通過三氯甲基芳基亞胺(RC(CCl3)=NH)的鹼性水解來合成,即Houben-Fischer合成。[13][14]
反應
[編輯]氰基基團可以在不同的的條件和試劑中進行不同的反應,包括:水解反應、氫化反應、還原反應或者成為離去基團(氰基)而進行取代反應。
水解反應
[編輯]水解腈RCN在酸性或者鹼性條件下會經過不同的水解歷程,得到酰胺 RC(=O)NH2然後繼續水解再得到羧酸RCOOH。腈的水解被普遍認為是製備羧酸的最佳方法之一。然而這些酸、鹼催化的反應對於製備酰胺都有一定的局限性。主要的局限性在於:無論是酸或鹼催化的反應,最終中和過程會導致大量的氰鹽生成,從而引起污染問題。
腈完全水解的方程式為:[15]
- RCN + 2 H2O + HCl —Δ→ RCOOH + NH4Cl
- RCN + H2O + NaOH —Δ→ RCOONa + NH3
還原反應
[編輯]在有機還原反應中,腈通過氫氣和鎳催化劑進行還原,產物是一個氨。(參見腈的還原)。腈還原成亞胺然後進行水解反應得到醛,即Stephen醛合成。
親核反應
[編輯]氰基碳原子是一個親核中心,因此可以發生親核加成反應:
- 和有機鋅化合物發生Blaise反應。
- 和醇發生Pinner反應。
- 類似的反應:胺、肌氨酸和氨腈反應得到肌酸。[16]
- 腈通過Houben-Hoesch反應得到酮,該反應機理就是Friedel-Crafts酰化反應。
烷基化反應
[編輯]去質子的氰基能作為強有力的親核試劑而用於烷基化親電試劑,這裏關鍵在於氰基離子 CN 的較小位阻和它獨特的穩定性。這些特性都使得高位阻碳-碳鍵的合成可以理想的通過腈中間體來達成,因此腈中間體廣泛的應用於合成藥物靶分子和醫藥原料。[17]
雜記
[編輯]- 在還原去氰基反應(reductive decyanation)中,氰基被氫原子取代。[18] 如:用HMPA和金屬鉀在叔丁醇中發生溶解金屬還原反應。α-氨基腈可以通過四氫鋰鋁去氰基。
- 腈在鹼性條件下可以發生自身的親核加成反應,即Thorpe反應。
- 在有機金屬化學中,腈對炔烴進行加成反應,稱為碳氰化反應(carbocyanation):[19]
有機氨基腈
[編輯]氨基腈(Cyanamides)是一種N-氰基的化合物,具有通式:R1R2N-CN,它相似於無機化合物氰胺(cyanamide)。
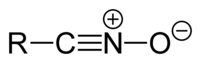
腈氧化物
[編輯]腈氧化物具有通式R-CNO。
參見
[編輯]參考文獻
[編輯]- ^ IUPAC Gold Book nitriles (頁面存檔備份,存於互聯網檔案館)
- ^ NCBI-MeSH Nitriles (頁面存檔備份,存於互聯網檔案館)
- ^ David T. Mowry. The Preparation of Nitriles ([失效連結] – Scholar search). Chemical Reviews. 1948, 42 (2): 189–283. doi:10.1021/cr60132a001.[永久失效連結]
- ^ J. Pelouze. Notiz über einen neuen Cyanäther. Annalen der Chemie und Pharmacie. 1834, 10 (2): 249. doi:10.1002/jlac.18340100302.
- ^ Hermann Fehling. Ueber die Zersetzung des benzoësauren Ammoniaks durch die Wärme. Annalen der Chemie und Pharmacie. 1844, 49 (1): 91–97. doi:10.1002/jlac.18440490106.
- ^ Peter Pollak, Gérard Romeder, Ferdinand Hagedorn, Heinz-Peter Gelbke "Nitriles" Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a17_363
- ^ Chun-Wei Kuo, Jia-Liang Zhu, Jen-Dar Wu, Cheng-Ming Chu, Ching-Fa Yao and Kak-Shan Shia. A convenient new procedure for converting primary amides into nitriles. Chem. Commun. 2007, 2007 (3): 301–303. PMID 17299646. doi:10.1039/b614061k.
- ^ Sharwan K, Dewan, Ravinder Singh, and Anil Kumar. One pot synthesis of nitriles from aldehydes and hydroxylamine hydrochloride using sodium sulfate (anhyd) and sodium bicarbonate in dry media under microwave irradiation (PDF). Arkivoc. 2006: (ii) 41–44 [2011-03-06]. (原始內容 (open access)存檔於2007-09-26).
- ^ W. Nagata and M. Yoshioka (1988). "Diethylaluminum cyanide". Org. Synth.; Coll. Vol. 6: 436.
- ^ W. Nagata, M. Yoshioka, and M. Murakami (1988). "PREPARATION OF CYANO COMPOUNDS USING ALKYLALUMINUM INTERMEDIATES: 1-CYANO-6-METHOXY-3,4-DIHYDRONAPHTHALENE". Org. Synth.; Coll. Vol. 6: 307.
- ^ Reynold C. Fuson, Oscar R. Kreimeier, and Gilbert L. Nimmo. Ring Closures In The Cyclobutane Series. Ii. Cyclization Of Α,Α′-Dibromo-Adipic Esters. J. Am. Chem. Soc. 1930, 52 (10): 4074–4076. doi:10.1021/ja01373a046.
- ^ Franchimont Reaction. [2011-03-06]. (原始內容存檔於2020-09-28).
- ^ Über eine neue Methode zur Darstellung cyclischer Nitrile durch katalytischen Abbau (I. Mitteil.) (p 2464-2472) J. Houben, Walter Fischer Berichte der deutschen chemischen Gesellschaft (A and B Series) Volume 63, Issue 9 , Pages 2464 - 2472 doi:10.1002/cber.19300630920
- ^ http://www.drugfuture.com/OrganicNameReactions/ONR197.htm (頁面存檔備份,存於互聯網檔案館) Merck & Co., Inc., Whitehouse Station
- ^ 羧酸的製備——腈水解 (頁面存檔備份,存於互聯網檔案館). 北京中醫藥大學遠程教育學院
- ^ Smith, Andri L.; Tan, Paula. Creatine Synthesis: An Undergraduate Organic Chemistry Laboratory Experiment. J. Chem. Educ. 2006, 83: 1654 [2011-03-06]. doi:10.1021/ed083p1654. (原始內容存檔於2008-07-04).
- ^ Tetrahedron Volume 61, Issue 4, 24 January 2005, Pages 747-789 doi:10.1016/j.tet.2004.11.012
- ^ The reductive decyanation reaction: chemical methods and synthetic applications Jean-Marc Mattalia, Caroline Marchi-Delapierre, Hassan Hazimeh, and Michel Chanon Arkivoc (AL-1755FR) pp 90-118 2006 Article[永久失效連結]
- ^ Yoshiaki Nakao, Akira Yada, Shiro Ebata, and Tamejiro Hiyama. A Dramatic Effect of Lewis-Acid Catalysts on Nickel-Catalyzed Carbocyanation of Alkynes. J. Am. Chem. Soc. (Communication). 2007, 129 (9): 2428–2429. PMID 17295484. doi:10.1021/ja067364x.
外部連結
[編輯]- 國際純化學和應用化學聯合會,化學術語概略,第二版。(金皮書)(1997)。在線校正版: (2006–) "nitrile"。doi:10.1351/goldbook.N04151
- 國際純化學和應用化學聯合會,化學術語概略,第二版。(金皮書)(1997)。在線校正版: (2006–) "cyanide"。doi:10.1351/goldbook.C01486